本文摘自<常春月刊>
文/張金堅(乳癌防治基金會董事長)
氧氣是人體每個細胞生產能量的必需元素,細胞沒有氧氣就不能正常地生產能量。幾乎所有動物體內的細胞,都要利用氧氣才能將食物轉化為能量,德國生化學家瓦伯格(Dr. Otto Warburg,1883~1970)於1923年提出「癌症是由細胞的呼吸系統缺氧引起」的理論,這就是著名的「瓦伯格效應」,他也因此贏得1931年諾貝爾生醫獎。
他在一篇以《癌症的主要成因和預防》(The prime cause and prevention of cancer)為題的文章指出:「癌症的成因已不再是一個謎,我們知道,當任何細胞缺氧超過60%它的氧需求量,癌變就會發生。」幾十年後,美國國家癌症研究所(National Cancer Institute, NCI)的兩位研究者Dean Burn和Mark Woods進行了一系列實驗。進一步驗證瓦伯格的理論,他們發現,當降低細胞的氧含量,細胞開始用「無氧」糖解(glycolysis)生產能量;當氧降低到夠低的水平時,它們最終會癌變。
在二十世紀初,比利時醫學家Corneille Heymans就發現了血氧可以透過頸動脈體(carotid body)來控制呼吸頻率,也因此榮獲1938年諾貝爾生醫獎。不過除了頸動脈體可快速適應缺氧環境外,還有其他生理機制也參與其中。另一個關鍵是稱為「紅血球生成素(erythropoietin, EPO)」的糖蛋白激素濃度升高,會增加紅血球生成量以提高攜氧量,但長期以來,科學家們並不清楚細胞如何去適應及控制體內氧氣值的變化。
直到後半個世紀後,英國分子生物學家Sir Peter J. Ratcliffe研究觀察到,缺氧會使紅血球生成素增加,美國醫學家Gregg L. Semenza則發現缺氧誘導因子(hypoxia-inducible factor, HIF),並進一步研究發表HIF由HIF-1α亞基與HIF-1β亞基兩部分組成。美國癌症學家William Kaelin又發現了VHL蛋白質(von Hippel-Lindau)在氧氣充足時會把HIF-1破壞,但缺氧會讓VHL功能不彰,導致HIF-1、紅血球生成素等都增加,促進血管新生,為缺氧環境帶來更多氧氣。
這三位學者各自發現的蛋白質,在動物缺氧的環境中,上游、中游和下游的蛋白質會「一條鞭」式地反應,讓動物細胞適應缺氧,這對心臟和腦部等高耗氧器官,是很重要的生理機制功能。這些發現更可應用在癌症治療,因為癌症腫瘤就是生長在缺氧環境中。這三位科學家的發現可謂在細胞缺氧研究過程中互相呼應又互相銜接,此等傑出的研究,終於在2019年共同獲得諾貝爾生醫獎(如圖一)。
圖一:近三十多年來與缺氧相關研究及重大發現之歷史回顧
.jpg)
缺氧與癌症進展的關係
眾所皆知,癌症的特徵是逃避細胞凋亡的機制,產生自給自足的生長信號,對抑制生長因子的不敏感、持續的血管新生、具有無限複製潛力以及組織侵襲與遠處轉移。為了不斷增殖,在腫瘤血管生成因子的影響下,腫瘤形成自己的血管網絡和血液供應。血管新生和腫瘤細胞的生長,有著重大關係:在腫瘤剛形成時,大小在1~2mm³的癌細胞,只需靠細胞間的擴散作用,就可直接吸收周遭環境的養份或排除代謝廢棄物,即可存活;然而一旦腫瘤生長大小超過3mm³,細胞間的擴散作用就會不足,必需依賴血管新生的機制,來提供腫瘤生長的環境;否則腫瘤內部會因細胞生長過於旺盛而導致缺氧(hypoxia),及因為代謝物的累積而酸化,最終誘發細胞凋亡(apoptosis)及細胞壞死(necrosis)。
隨著腫瘤持續成長,此時有許多癌細胞會被推擠至距離血管較遠的區域,它們不但缺乏養分供給,也缺少足夠氧氣,如果不設法改善惡劣的生長環境,癌細胞無法存活只能走向死亡。而且這些新形成的血管網絡與正常健康組織中的不同,呈現出一系列結構和功能改變。而這些改變可能會干擾血液和氧氣的充足供應,從而導致缺氧狀態。腫瘤微環境與缺氧狀態已被研究了數十年,其影響癌細胞是多方面的。通常正常組織中氧氣(O2)的供應量可以滿足細胞生長的需要,但由於腫瘤新形成血管的結構和功能異常,O2從毛細血管擴散到腫瘤的範圍受到限制,從而導致腫瘤中發展出缺氧區域。
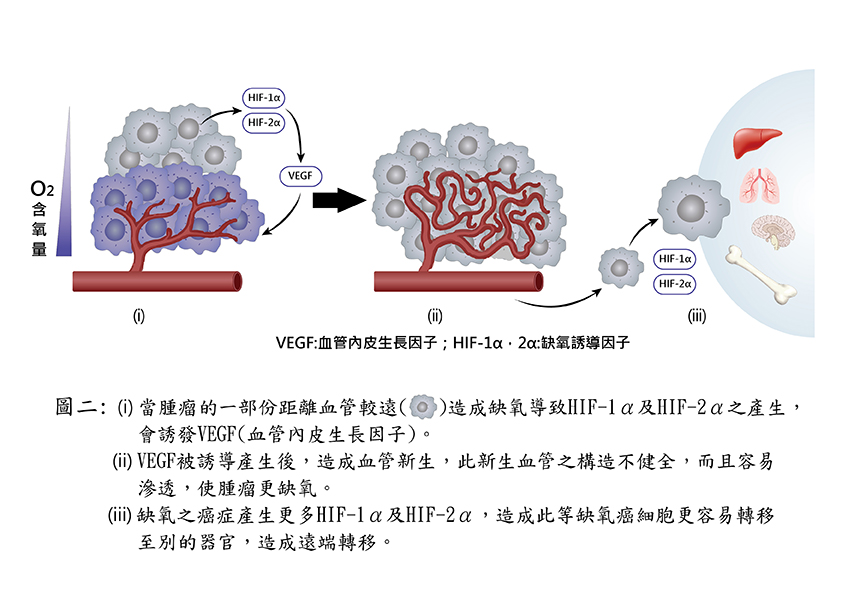
缺氧是腫瘤微環境的基本特徵之一,缺氧也是決定腫瘤惡性化發展的重要因素。缺氧不但會誘導癌症幹細胞產生,使放射線治療失效,以及對化學治療產生耐藥性等問題,更重要的是,缺氧還會促進癌細胞的快速生長和轉移。近年來發現,細胞內氧含量的下降,會透過一系列的信號傳遞,激發了對缺氧環境敏感的缺氧誘導因子(HIF)的活性,當HIF這個轉錄因子表現增加後會活化「血管內皮細胞生長因子」(vascular endothelial growth factor, VEGF)基因表現,癌細胞內新生成的VEGF會進一步分泌到腫瘤組織並刺激微血管新生,如此可解除腫瘤內部缺氧的危機,也提供腫瘤持續增長的條件(如圖二)。再透過一連串細胞內訊號的傳遞,最後導致了癌細胞內與缺氧相關的基因之表現。
圖二:癌組織缺氧嚴重時會有(i)至(iii)之變化,造成遠處轉移
癌細胞的缺氧訊號是一個受到多重因子調控之過程。缺氧透過調節細胞內氧感應器分子,使其結構發生改變,並透過其他的影響因子,例如活性氧基(reactive oxygen species, ROS)產生而引發反應,其中最重要的是促使缺氧誘導因子HIF- 1α的磷酸化,並且與HIF-1β結合而形成一個完整的HIF-1複合體,之後再與相對應於基因上的缺氧反應元(hypoxia response element, HRE)結合,促進某些基因(如血管內皮生成因子基因)的表達,於是促進了腫瘤旁邊微環境的血管新生作用。
總之,癌細胞的缺氧訊號通路是一個受多重因素調控的複雜過程。缺氧通過直接或間接的方式作用於氧感應器分子,使其結構發生改變,並透過第二信使-活性氧基(ROS)與激酶系統發生互動關係:在缺氧時期,活性氧的累積會激活PI3k/Akt(protein-kinase B)和MAPK/ERK(extracellular signal-regulated kinase)等訊息傳遞途徑,促使缺氧特異性轉錄因子-HIF-1α的磷酸化並與HIF-1β結合而形成一個完整的HIF-1轉錄複合體,進而促進下游基因的活化與表現,這對於維持癌變及腫瘤血管生成至關重要。
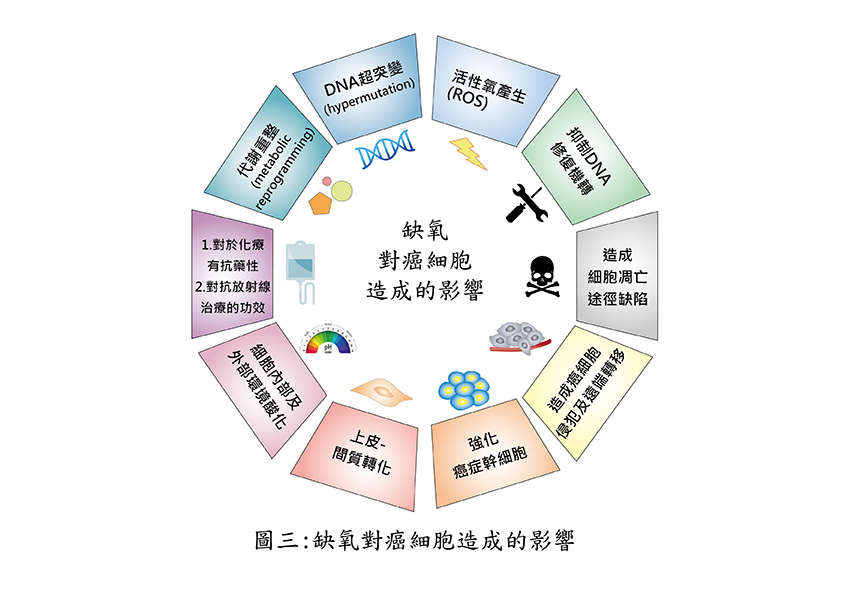
缺氧對癌細胞造成的影響
腫瘤通常會因為癌細胞生長的調控異常,必然會產生某些缺氧區塊;缺氧會促使腫瘤產生缺氧誘導因子以改變癌細胞的代謝,並誘使腫瘤發炎,進而產生一連串的惡果:
❶促進癌細胞的生長與惡化。
❷讓癌細胞對於化療、放療極度不敏感。
❸誘導腫瘤內充斥著負面的發炎細胞,使抗癌免疫力降低;這往往讓昂貴的抗癌免疫療法有如肉包子打狗,不易產生療效。
❹也會促成癌細胞侵襲、轉移至遠處器官。
❺最可怕的在於缺氧會誘導腫瘤內產生「癌幹細胞」,讓癌細胞生生不息(圖三)。
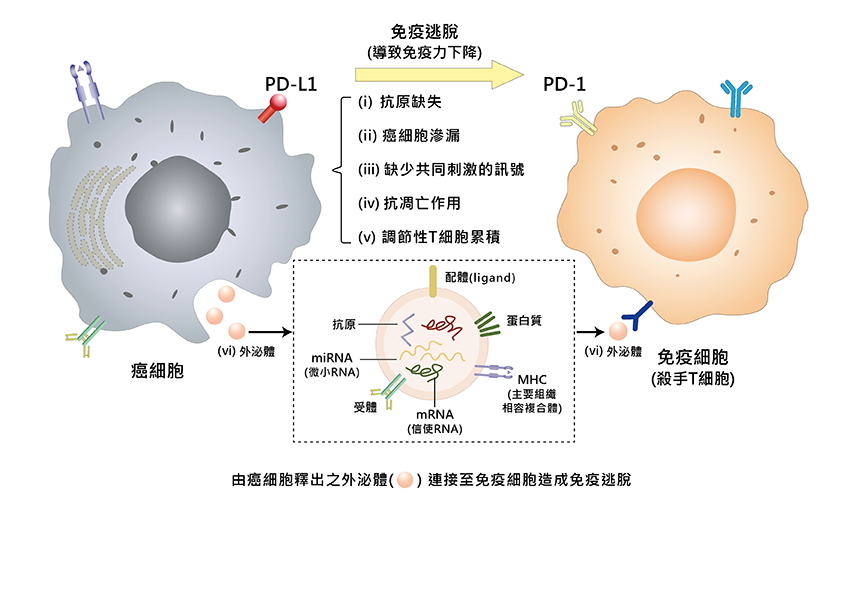
當腫瘤缺氧時,癌細胞或腫瘤內的發炎細胞還會分泌「細胞程式死亡配體-1(PD-L1)」,會與殺手T細胞之PD-1結合,進而壓抑殺手T細胞;缺氧、發炎的腫瘤也會分泌其他免疫抑制因子,如圖四所示,透過(i)~(vi)等機制,逃避免疫監視造成免疫功能低下。因此,不管我們的抗癌策略組合是開刀手術、化學治療、放射治療、免疫療法,我們都要設法讓腫瘤不缺氧。
圖四:癌細胞缺氧時造成免疫力下降
圖說:
由於癌細胞因為缺氧造成(i)~(v)之變化,加上缺氧癌細胞分泌許多外泌體跑至免疫細胞,使免疫細胞之功效喪失(vi),透過這六項機制(i)~(vi),導致病人免疫力下降。
第一型缺氧誘導因子(HIF-1)參與的癌症抗藥性機制
除了HIF在常氧和缺氧環境中的作用外,大量研究證實HIF-1在缺氧誘導的抗藥性中也發揮著相當的作用。然而HIF引起抗藥性的分子機制是錯綜複雜的,並取決於腫瘤的種類,大致可分為以下幾種情況:
❶HIF-1參與藥物外流的調節。Comerford等人在2002年就已經發現,HIF-1在低氧環境中可以活化多重抗藥基因(multidrug resistance 1, MDR1)的表現,MDR1進一步誘發P-gp(P-糖蛋白)的表現,P-糖蛋白可以降低細胞內化療藥物的濃度,而這一現象在胃癌、乳癌以及大腸癌中都會發生。
❷HIF-1參與細胞增殖和存活水平的改變。細胞凋亡的缺陷和細胞週期調節的改變均是抗藥性產生的重要影響因素。研究發現,HIF可以調節一系列促凋亡因子(如BNIP3、NIX和NOXA)以及抗凋亡因子(如Bax、Bcl-xL、Bcl-2、NF- kB、p53和survivin)的表現。同時,HIF-1也可以透過靶基因BNIP3的激化,引起自噬反應(autophage)的產生,但HIF-1在調節凋亡過程中的確切作用還有待進一步研究。Rohwer等人發現,在胃癌細胞中,HIF-1拮抗化療藥物誘導的凋亡途徑可能是透過抑制p53路徑。
❸HIF-1參與DNA 損傷的抑制。研究發現,HIF-1可以透過滅必治或癌妥滅(Etoposide),一個經典的DNA雙鏈斷裂誘導劑,發揮更強的抗藥性作用。
❹HIF-1參與代謝重整。腫瘤惡性轉化與代謝重整密切相關,HIF-1可以透過不同的機制降低粒線體的活性,進而不僅控制了凋亡和壞死的發生,而且降低了活性氧基的產生,最終導致治療失敗。
HIF-1在癌症生物學的幾個關鍵步驟,扮演著重要作用,包括腫瘤血管生成(angiogenesis),葡萄糖和能量代謝的調節,腫瘤侵犯(invasion)和轉移。目前世界各地研究者正在採取幾種抑制HIF- 1活性的方法,包括RNA干擾(RNA interference)和小分子抑制劑等。Semenza教授團隊當前研究的重點是HIF-1在人類乳癌的血管和淋巴轉移中扮演的角色。他們正在研究改變HIF-1活性對腫瘤生長,代謝和血管形成的影響,雖然目前仍在臨床前模型(preclinical model)中。這些研究將提供原理證明,抑制HIF-1活性是一種新的癌症治療策略。
針對缺氧機制與腫瘤治療發展
針對缺氧機制所衍生的治療方式,多是以HIF-1為治療標的。目前在研發中的HIF-1抑制劑,根據其作用機制可分為五大類:1. HIF- 1α mRNA表達的抑制劑;2. HIF-1α蛋白轉譯(translation)抑制劑;3.影響HIF-1α降解途徑的抑制劑;4. HIF-1與DNA結合的抑制劑;5. HIF- 1α轉錄(transcription)活性抑制劑。
由於HIF-1抑制劑的單一藥物治療可能缺乏足夠抗腫瘤活性,加上由抗VEGF治療引起的缺氧帶來新的挑戰,因而為開發抗VEGF藥物與HIF-1抑制劑的聯合策略提供了新機會,這一點甚至更為重要。當然,這些都有待進一步設計更良好的HIF-1抑制劑之臨床試驗。以確認其活性並找出可用於聯合治療的藥物。
在缺氧環境下,細胞所因應的感應機制與生理調節不但可以套入任何細胞,癌細胞更是沒放過濫用此機制的機會。因此,在這條訊息傳導路徑上尋找可以「用藥」的標的,也一直是新藥研發的重點所在。現在有很多奈米及新藥,就是看準腫瘤的核心缺氧特徵,希望透過藥物進到癌腫瘤裡,破壞HIF-1的穩定性。但是仍需要時間和進一步臨床實驗來驗證。
結語
諾貝爾醫學獎雖然只頒給了三位實至名歸的科學家,但更重要的是後續一棒接一棒,使整個領域持續發展,發揚光大。我們正步入腫瘤研究和治療的黃金年代。雖然,洞悉和控制癌症的征程充滿挑戰,但是近年來的許多癌症研究和治療方面的進展著實讓人驚喜。我們有更多的理由相信,戰勝癌症的未來終會降臨。
我們一直走在戰勝疾病的路上,我們曾戰勝了無數的疾病,也許還會出現很多難以想象的疾病,但我們終將戰勝它們。正如美國頗負盛名的史隆.凱特寧癌症中心(MSKCC)的腫瘤學家Joan Massague博士所說,「人類正在將癌症從絕症轉變為常規疾病,很多其他傳染性疾病都有抗生素或者其他治療手段,而我們與癌症的關係也終將變成那樣。」
延伸閱讀:
。張金堅:「發炎」知多少?舊醫學,新詮釋
。張金堅:癌症新希望:談細胞治療扮演的角色



