.jpg)
文/張金堅、葉顯堂
2025年10月6日在瑞典卡羅林斯卡醫學院的諾貝爾委員會,正式宣布將2025年度諾貝爾生理獎或醫學獎授予西雅圖系統生物學研究所(Institute for System Biology)的瑪麗·E.布倫科(Mary E. Brunkow),美國舊金山索諾馬生物治療公司(Sonoma Biotherapeutics)的弗雷德·拉姆斯德爾(Fred Ramsdell),及日本大阪大學的坂口志文(Shimon Sakaguchi),以表彰他們在「周邊免疫耐受性」的開創性發現,並凸顯調節性T細胞在免疫系統的調控機制方面扮演重要任務。
以下本文將介紹人體的免疫系統及各種T細胞,包括調節性T細胞(Treg)的由來、功能,以及三位得獎者在這方面的個別貢獻,更進一步了解調節性T細胞在自體免疫、器官移植及癌症治療等三方面佔有的關鍵角色。(圖一)
.jpg)
人體的免疫系統
人體每天都要面對外界的病原體,例如細菌、病毒、真菌等入侵者,而我們身體的免疫系統就像國家的防衛部隊,分工嚴密,此免疫系統的主力是由骨髓產生的白血球前身,包括:
❶B細胞在骨髓中分化完成,負責製造抗體。
❷T細胞源自骨髓,再送往胸骨後方的胸腺接受訓練,所以,胸腺可謂是免疫系統的中樞訓練營。
未成熟的T細胞稱為「初生T細胞」,主要是由骨髓送往胸腺接受訓練,必需經過兩道考驗。第一道叫「正選擇」,是要確認他們能辨識外來入侵敵人;第二道叫「負選擇」,負責淘汰那些誤將自身組織當成敵人的細胞。經過這二道篩選後,剩下約五百分之一的T細胞訓練完成,進入周邊血液,即所謂成熟的輔助性T細胞(Helper T cell)、毒殺性T細胞(Killer T cell)或調節性T細胞(Regulatory T cells)。
此等免疫系統包括有如國家防衛部隊的戰鬥部隊及維和部隊,二者的工作互相協調、平衡,平時巡邏防守,發現入侵者,戰鬥部隊如毒殺性T細胞就會出手攻擊;但為了確保不要誤傷自己人,就要靠維和部隊,即所謂調節性T細胞,負責平衡,不能使火力過大,免疫反應太激烈,使免疫系統能夠維持在「穩定」與「平衡」的狀態。(圖二)
.jpg)
調節性T細胞的由來及功能
回顧免疫學的發展,在1980年至1995年之間,當時免疫學界都認為,免疫系統的自我耐受性完全是在胸腺中,即所謂的中樞耐受性(central tolerance),其普遍的觀念是認為透過中樞耐受性的過程,任何可能對自身產生攻擊性反應的免疫細胞,在成熟之前就會在胸腺中被清除殆盡。
但坂口志文教授早在1980年代便注意到人體的免疫調節機制遠遠比想像中來的複雜,他認為有一群特殊的T
這些調節性T細胞會分泌抑制性細胞激素(如IL-10、TGF-β等),或直接干擾其他免疫細胞(T細胞、B細胞、樹突細胞)的活性,為免疫系統「踩下煞車」來維持免疫功能的平衡。此免疫平衡的機制,使醫學界重新思考免疫系統的本質不是對抗,而是如何維持平衡與調和;坂口教授發現這群「調節性T細胞」不只震撼免疫學界,也為後續「周邊免疫耐受」(Peripheral tolerance)的研究奠定了蓬勃發展的基礎。(圖三)
.jpg)
如上所述,免疫反應需要在「攻擊外敵」與「避免自體傷害」間取得平衡,如同在「踩油門」與「踩煞車」之間取得適度的調整與和諧;Treg正是維繫這種平衡的要角之一。沒有足夠的Treg,免疫系統可能會呈現過度活躍,導致攻擊自身組織(引發自體免疫疾病);相反地,若Treg活性過強或在不該出現的場所堆積,免疫反應就會被過度抑制,可能讓腫瘤等「敵人」有機可乘,甚至坐大,進而擴散或轉移。
因此,Treg在不同情境下有「雙面刃」般的效果:一方面維持自我耐受是好的,但另一方面也可能抑制對腫瘤或病原體的正常免疫防禦,導致腫瘤增大與擴散。以下我們將探討Treg在自體免疫疾病、器官移植及癌症治療中扮演的角色,以及科學家如何運用或調控Treg來治療這些疾病。
至於瑪麗.E.布倫科的主要成就在於她參與了對(IPEX)(免疫失調、多發性內分泌病、腸病、X染色體關聯)綜合徵相關基因的發現。IPEX是一種罕見的遺傳性自體免疫性疾病,主要影響男性,其特徵是嚴重的自體免疫反應,包括1型糖尿病、濕疹和腹瀉;布倫科和她的團隊發現,IPEX綜合徵是由於FOXP3基因的突變引起的。而FOXP3基因編碼是一種轉錄因子,對於調節性T細胞的發育和功能至關重要。
她發現,FOXP3基因的突變會導致調節性T細胞的功能喪失,從而導致免疫系統無法正常抑制自身反應,進而引發IPEX綜合徵兆。這項發現不僅解釋了IPEX 綜合徵兆的發病機制,也讓我們充分理解調節性T細胞在免疫耐受中的作用提供了重要的線索。
有關弗雷德·拉姆斯德爾的貢獻亦與FOXP3基因的功能密切相關。他獨立於布倫科的團隊,也發現了FOXP3基因是調節性T細胞發育和功能的關鍵;拉姆斯德爾的研究進一步闡明了FOXP3基因如何調控調節性T細胞的基因表達,以及如何影響調節性T細胞的免疫抑制功能。
他本人及其團隊的研究證實了FOXP3基因的缺失,會導致嚴重的自體免疫性疾病。他們還發現,FOXP3基因的表達受到多種因素的調控,包括細胞因子和信號通路。這些發現為探討調節性T細胞的發育和功能提供了更深層的認識,也為開發針對FOXP3基因的治療策略,提供了相當有利的理論基礎。
總之,三位科學家的研究共同發現並證實了調節性T細胞在免疫系統調控中的核心作用。調節性T細胞是一群特殊的T細胞,它們具有抑制其他免疫細胞活性的功能,進而維持免疫耐受和預防自體免疫性疾病的產生。
調節性T細胞通過多種機制發揮其免疫抑制功能,包括:
◎分泌抑制性細胞因子:調節性T細胞能夠分泌IL-10和TGF-β等抑制性細胞因子,這些細胞因子能夠抑制其他免疫細胞的活性。
◎接觸依賴性抑制:調節性T細胞能夠通過細胞表面的分子與其他免疫細胞相互作用,從而抑制其活性,例如,CTLA-4分子能夠與B7分子結合,從而抑制T細胞的活化。
◎代謝干擾:調節性T細胞能夠消耗局部環境中的IL-2等細胞因子,從而剝奪其他免疫細胞的生存和活化所需的信號。
◎抑制抗原呈現細胞的功能:調節性T細胞能夠抑制抗原呈現細胞(如樹突細胞)的功能,從而減少效應性T細胞(Effector T cell,Teff)的活性。
多項研究顯示調節性T細胞的缺陷或功能失調,與多種自體免疫性疾病的發生密切相關,包括第1型糖尿病、多發性硬化症、類風濕性關節炎和橋本氏甲狀腺炎;當然癌症診療及器官移植亦與調節性T細胞(Treg)有高度的相關性。(圖四)
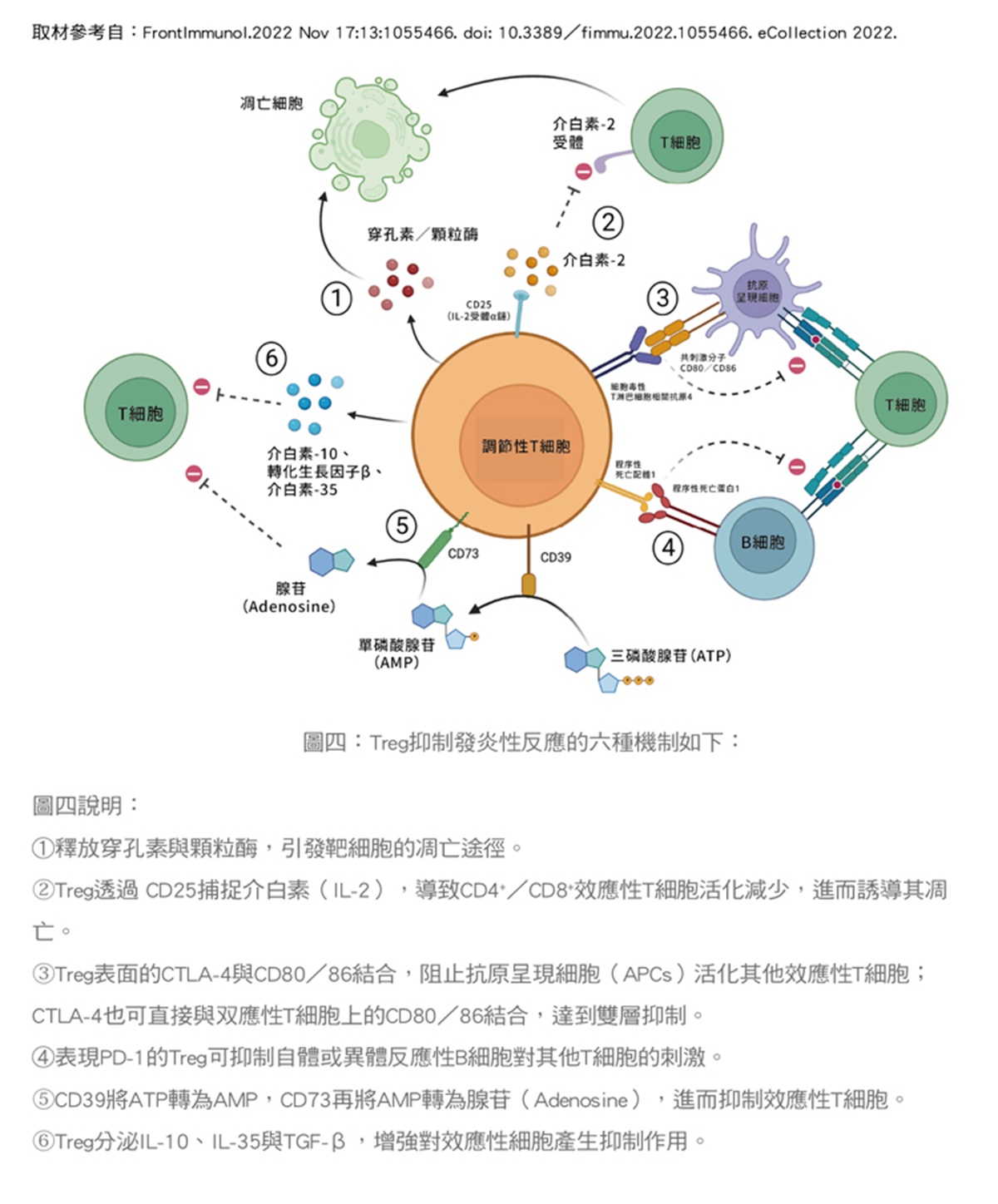
調節性T細胞在自體免疫疾病中扮演的角色
調節性T細胞在自體免疫疾病中的表現是「正面」的角色。自體免疫疾病(如第一型糖尿病、紅斑性狼瘡、類風濕性關節炎、多發性硬化症等),是因免疫系統錯將自己人體的正常細胞當做敵人攻擊所導致,這時候,Treg的抑制功能正好可以幫助平息自體免疫的風暴。
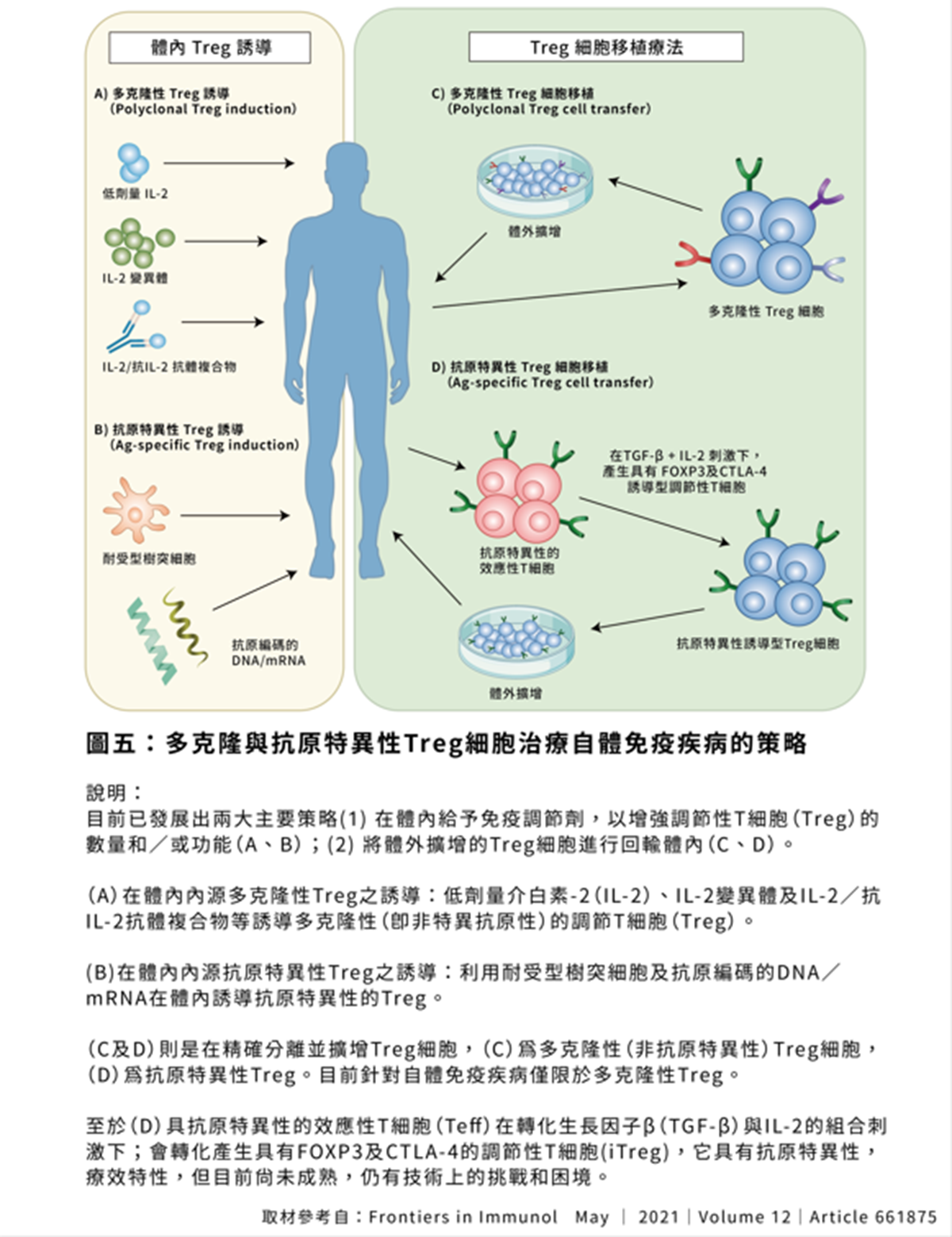
研究發現,許多自體免疫疾病患者體內的Treg數量或功能有所缺陷,導致免疫反應缺乏應有的剎車;因此,一個合理的治療策略是設法增加患者體內Treg的數量或活性,恢復免疫系統的平衡。正如專家學者所說:「提升Treg,讓免疫重回自我耐受」,目前多種方法正被用於實現這項目標。以下介紹幾種主要的Treg增強策略:
◎調節性T細胞的擴增和轉移:這種策略旨在擴增患者自身的調節性T細胞,然後將其轉移回患者體內,以增強免疫抑制功能,從而治療自體免疫性疾病。
◎調節性T細胞的基因修飾:這種策略旨在通過基因修飾技術,增強調節性T細胞的免疫抑制功能,從而提高治療效果。
◎調節性T細胞的靶向治療:這種策略旨在開發能夠選擇性地激活特定的調節性T細胞,而非全盤激活身體所有的調節性T細胞的藥物,從而調節免疫反應。(圖五)
調節性T細胞在癌症治療方面扮演的角色
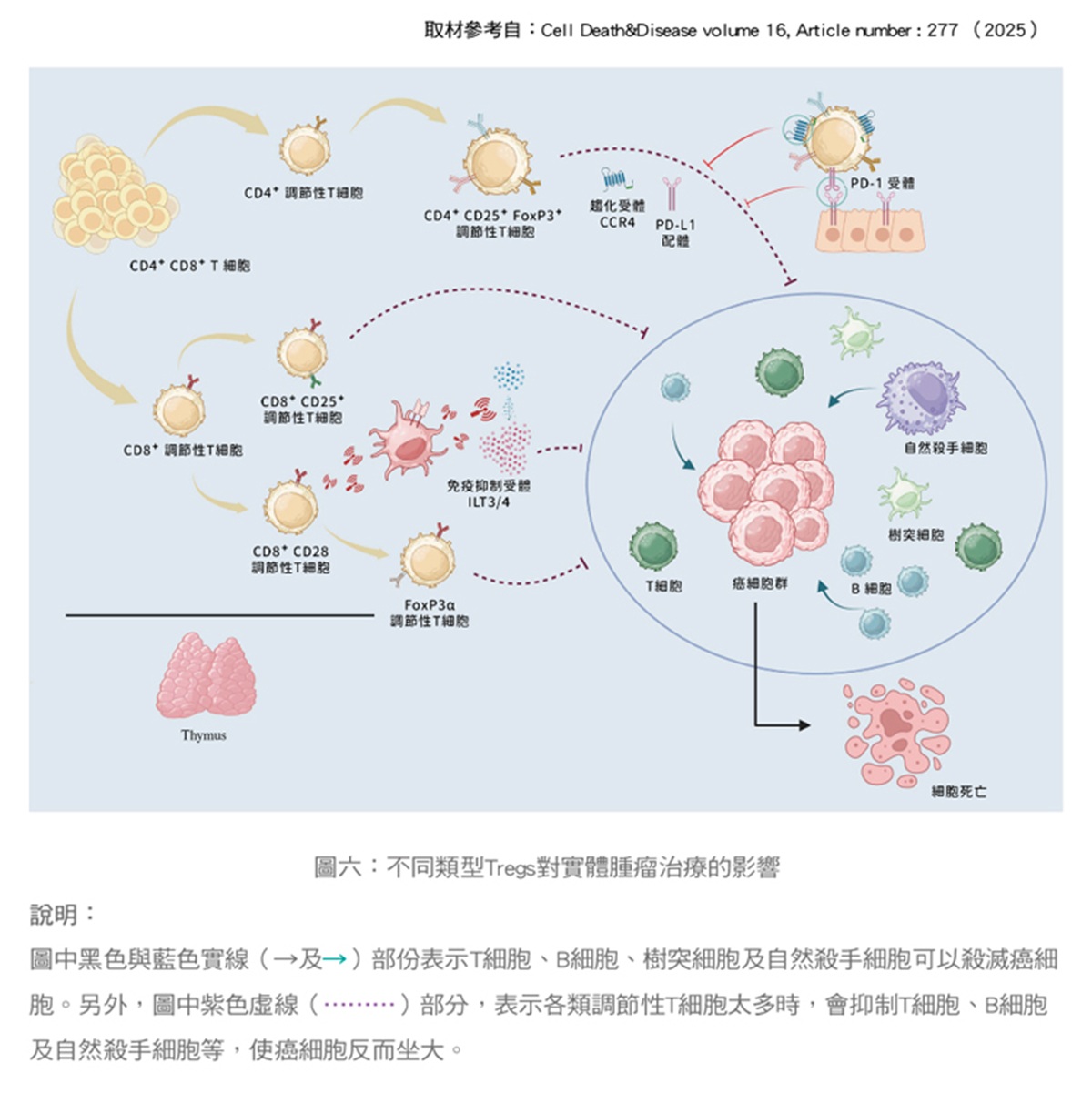
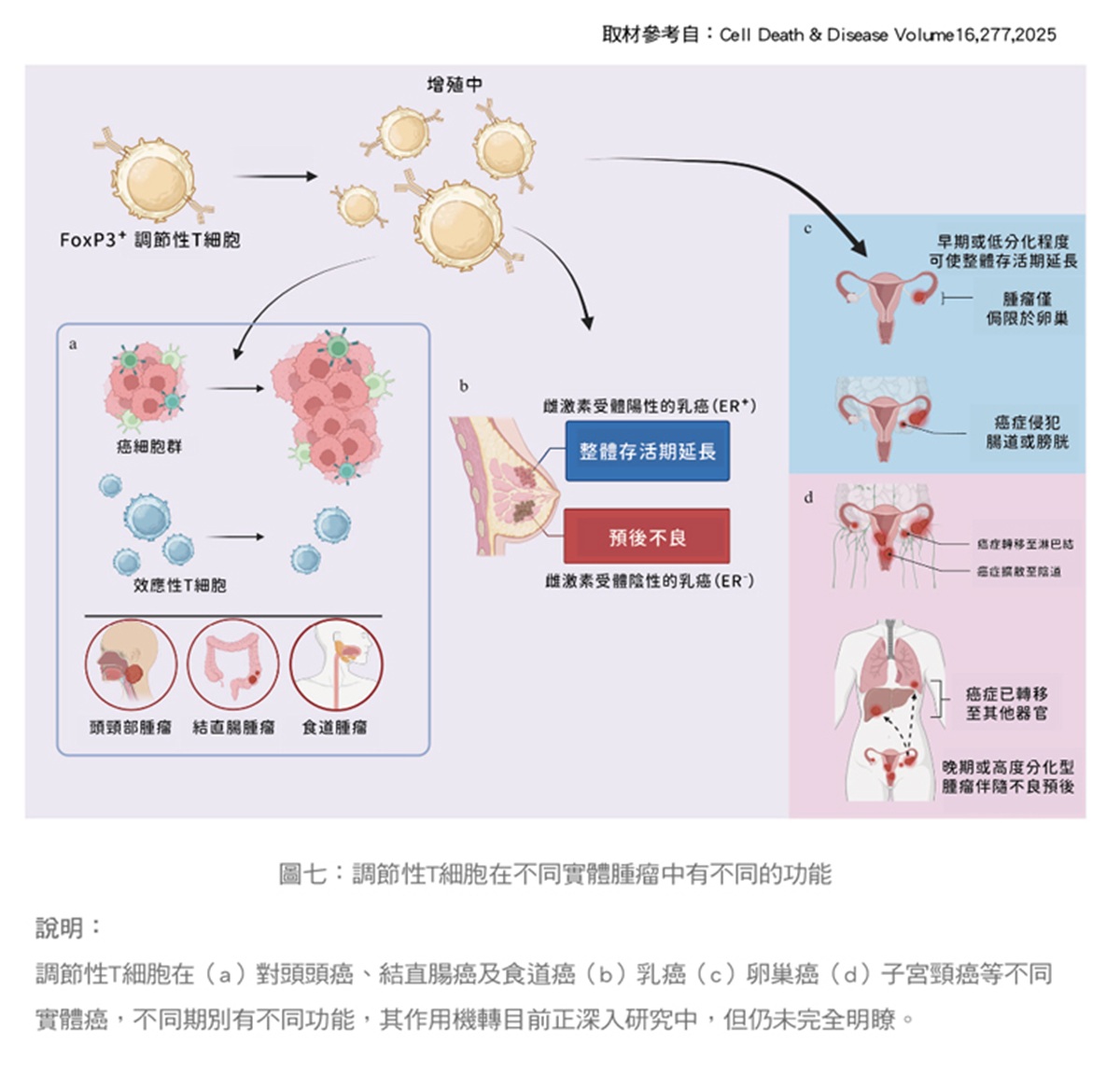
很多研究發現調節性T細胞能夠抑制對抗腫瘤的免疫反應,因此,如何抑制調節性T細胞功能,可能有機會可以提高癌症治療的療效。一般而言在癌症情境下,Treg經常扮演讓人體失望的「反派」角色。許多研究發現,各種類癌症組織中往往浸潤了大量的Treg細胞,它們透過抑制抗腫瘤的免疫作用,反而支持了腫瘤的生長和逃避免疫監視。正常人周邊血液中的Treg通常只佔CD4+ T細胞總量的約4%,但在腫瘤微環境中,Treg比例卻可升高到20~30%,形成一個強力的免疫抑制屏障。
大量Treg浸潤往往和較差的病人預後相關,因為它意味著腫瘤成功地削弱了患者的免疫攻擊力。Treg透過多種機制保護腫瘤細胞,例如直接接觸殺傷效應T細胞、分泌抑制性細胞激素(如IL-10、TGF-β)來關閉抗癌的免疫訊號,以及分解ATP產生腺苷來抑制周圍的免疫細胞活性。如此一來,腫瘤微環境就被改造成一個免疫抑制的空間,讓癌細胞躲過免疫系統的清除,進而坐大或擴散。
因為Treg往往幫助腫瘤對抗免疫系統,科學家積極探索各種方法抑制或移除腫瘤中的Treg,希望藉此增強抗癌免疫反應。但由於Treg同時維持全身免疫平衡,我們需要精準地針對腫瘤或其附近微環境的Treg,而不要傷及正常組織中的Treg,以免引發自體免疫副作用,其主要策略是利用①對應的單株抗體清除Treg ②阻斷Treg招募③代謝干擾策略等三種方法,來減少腫瘤內部及其微環境中調節性T細胞的數量或功能,使自身的免疫大軍(效應性T細胞)可以攻擊癌細胞。
然而這是一把雙面刃,如果殃及全身性的Treg減少,可能伴隨產生自體性免疫副作用,所以,理想的療法要有高度針對性,需要先找到腫瘤特有的Treg標誌,再將特有標誌的Treg抑制僅僅侷限在腫瘤部位,我們相信下一代更精準的免疫治療即將實現。(圖六、圖七)
調節性T細胞在器官移植方面扮演的角色
接受器官移植的患者往往長期使用抗排斥藥,抗排斥藥的使用卻常常增加感染率,如果接受移植病人接受自體Treg細胞,相對也許可以減少使用一些抗排斥藥,初步結果顯示,部分病人以極簡單而且少量對抗排斥藥可以長期活存且無排斥,這項成果顯示Treg有潛力改變傳統的一昧壓制免疫,轉為主動誘導耐受。
另外,最近有創新公司(如Orca Bio)更進一步將Treg預先混合進入造血幹細胞移植的「移植物」中:先選出CD34+造血幹細胞並加入一定比例的Treg,兩天後再回輸部分供者的常規T細胞。這種經過優化的「帶Treg移植物」在臨床I/II期研究中,帶來了快速的移植物著床,且患者移植物對抗宿主疾病(GVHD)的發生率和白血病復發率都低於傳統移植組。
目前該產品的第III期臨床(稱為Precision-T試驗)已完成招募,不久將解盲。如果成功,將為高危骨髓移植病人提供一種更安全有效的預防GVHD方案。當然,亦可以透過基因修改技術增強Treg細胞的免疫抑制功能,目前正在進行CAR -T細胞及利用CRISPR等基因編輯工具,直接優化Treg的特定功能,將來也可能是極有效的療法。
周邊免疫耐受及調節性T細胞研究的挑戰
儘管周邊免疫耐受研究已經取得了顯著的進展,但仍然存在許多困境與挑戰:
◎周邊免疫耐受機制的複雜性:周邊免疫耐受涉及多種複雜的機制,這些機制之間相互作用,共同維持免疫系統的自身耐受,對這些機制的深入理解仍然有待進一步研究。
◎免疫治療的個體差異:免疫治療的療效存在顯著的個體差異,因此,如何選擇合適的患者進行免疫治療,如何預測免疫治療的療效,以及如何克服免疫治療的耐藥性,是未來研究需要解決的重要問題。
◎免疫治療的副作用:免疫治療可能會引起嚴重的副作用,如自身免疫反應和細胞因子風暴;如何減少免疫治療的副作用,提高治療的安全性,是未來研究需要關注的重要問題。
結語
綜觀現在的研究趨勢,我們正站在Treg療法蓬勃發展的關鍵時刻。從癌症到自體免疫疾病,Treg這把「雙面刃」正被相關專家學者研究與瞭解:在加速油門或踩煞車之間,如何調節與維持平衡,應是當務之急。
最新的臨床試驗結果給我們帶來希望——在癌症免疫治療中,針對Treg的新型藥物有望與現有療法結合,提高抗腫瘤效果;在自身免疫和移植醫學中,增強或輸入Treg,則可減少對傳統免疫抑制藥的依賴,降低治療副作用。
特別值得期待的是融合了奈米醫學和合成生物學的下一代Treg療法,它們將使我們能更精準地調控免疫系統。
當然,挑戰依舊存在:如何避免Treg療法引發感染或腫瘤風險?如何確保外源Treg在體內長期存活且保持抑制性?這些問題都有待進一步研究與突破。
總之,調節性T細胞作為免疫平衡的守護者,正越來越受到醫學界的重視。隨著諸多領域創新科技的研發,未來的治療策略將更講求客製化,相信Treg相關療法將為癌症治療、自體免疫疾病及器官移植帶來更有效而且副作用更少的治療選擇,肯定會開啟免疫醫學的新里程碑,以造福人類。
(圖片來源:Dreamstime/典匠影像)



