
本文摘自<常春月刊>480期
文/張金堅(乳癌防治基金會董事長)
由於公共衛生的普及,加上醫療技術的進步,使全球人類的壽命大幅增加,許多國家都邁入高齡化社會;根據聯合國世界衛生組織(WHO)的預估,到2025年,全球60歲以上人口接近12億人,而到2050年,則會上升至20億人。
隨著老年人口的增加,相對與老化相關的疾病也會增加,所以「老化」的問題,一直是大家非常重視的議題。老化是一個慢性的過程,而其牽涉到的,當然是人體體內各器官的細胞會慢慢趨近於老化,也就是說具有老化的特徵,此種老化現象,英文特別叫做「Senescence」。大約在1950年起,對於老化的研究開始普遍,但對於老化的成因,有很多的看法與解說莫衷一是。
當然從基本的分子生物學、基因體醫學、生物演化、生物資訊及流行病學的研究與探討非常廣泛,而且非常分歧。本文嘗試綜合整理全世界與老化有關的相關研究,合成二集來闡述,第一集特別討論與老化有關的成因及其作用機轉;第二集特別敘述一些可以逆轉老化的相關研究及發展趨勢。
物種演化與生物老化的歷史回顧
早在亞里斯多德,甚至是更久遠的時代,就有人探討物種演化與生物老化的相關理論,提出所謂「物種利益」的概念,普遍認為生物的老化與死亡,是為了下一代的利益而死。
此理論也受到挑戰及爭議,西元1858年英國生物學家達爾文首次提出自然選擇(Natural selection,也譯為「天擇」)的觀念,他認為生物族群要快速生長及繁殖,但可用的資源有限,不是每個個體都存活;而影響存活率的因素很多,包括氣溫、濕度、日照、空氣以及各種生物因子,如食物、病原菌等,個體之間存在的個體差異,使每個個體的存活率不同。如果個體可以耐乾旱、在空中飛、在海裡呼吸、用爪子掠食、抵抗疾病、裝造各種功能用具,或者精於獵食,就有不同的適應能力。
這些個體差異如果可以遺傳,則會造成演化。當時達爾文的天擇演化論,得到大多數科學家的認同,但一直沒有人真正的去實際量測生物各種行為對適應度的影響,及至1950年代,大家認為天擇理論的主張已經過時。此時才由G.C.威廉斯(G.C. Williams)在其著作《適應與自然選擇》書中提到「自私基因」,後來亦得到另外二位演化生物學家霍爾登(J.B.S Haldane)、梅達華(Peter B.Medawar,他曾於1960年獲得諾貝爾生醫獎)之認同,他們認為個體在受到自私基因的驅使之下,會儘可能努力快速地繁殖,只要不危及生命安全。
換言之,一個物種的演化是為了提升整體適應度,將自己的基因儘可能地傳給整個群體(而不是個別的個體),於是整個族群都會朝向進化穩定策略(evolutionarily stable strategy)。因而在1976年英國演化生物醫學理查道金斯(Richard Dawkins)寫了《自私基因》這本書,也正式提出了「複製者」(Replicator)的概念,所謂生物體內的複製者就是由核酸組成的基因,而且此等基因透過轉錄與轉譯的方式,製造出蛋白質加上磷脂與多醣結合的外殼作為保護與武裝自身的「生存機器」(Survival Machine)可以代代相傳。由於細胞的複製而得以代代相傳,但為什麼細胞會老化,也一直困惑著學術界。
要解釋細胞老化絕非易事,除了要吻合所有已知的物理及化學定律以外,還要與幾世紀以來的生物觀察結果相符,從分子層次至生物演化學均要涉及,在1950~
老化的特徵
老化一直是相關專家學者競相研究的熱門領域。不管從分子、細胞、組織乃至器官的層次,都有深入的探討,及至2000年以後對於老化的標誌、成因及作用機轉,已較有深層的了解。在2013年《Cell醫學期刊》中,由歐洲Manuel Serrano等多國學者之綜述裡,特別闡述老化的九大特徵(如圖一),包括(1)DNA受損導致基因不穩定性(genomic instability)、(2)保護染色體末端結構(telomere)損傷之端粒、(3)控制基因開關的表觀基因體發生改變、(4)失去維持健康蛋白質的能力,即喪失蛋白質恆定(proteostasis)功能、(5)新陳代謝變化引發營養攝取(Nutrient sensing)失調、(6)粒線體功能失調、(7)累積衰亡的殭屍細胞導致發炎反應而使健康細胞受傷,導致細胞衰老、(8)幹細胞耗竭、(9)細胞間通訊(intercellular communication)改變,產生發炎分子。
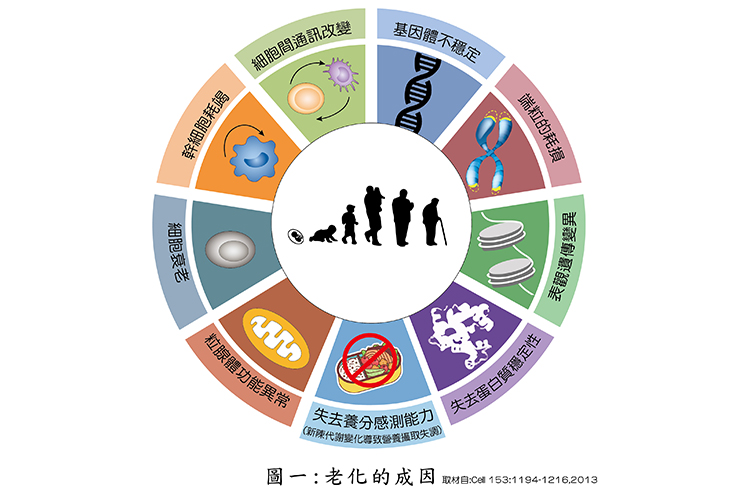
在2013年以前,大部分研究者對這些老化特徵,都著重在討論如何減緩老化或預防老化。但對於老化的成因較少探討,而這十年來由於次世代定序引用及先進的生物資訊技術的進步,具有高效率處理及運算能力,已開始探討細胞老化的成因。
根據英國劍橋大學Dr.Danrd Mañoz-Epsin在《FEBS醫學期刊》(2021年)的綜述裡特別指出,其實細胞老化有其正常的生理機轉及不正常病理機轉二個層面。正常的生理機轉可使傷口癒合,促進胚胎發育等,不正常的病理機轉則可能導致退化性疾病、心臟血管疾病、免疫、新陳代謝疾病乃至癌症。
目前從細胞老化的特徵,已從圖一進展到更高一層的境界,如圖二所示,綜觀生物(包括人類)的一生,細胞累積了一連串的壓力與刺激造成不可逆的傷害。這些壓力及刺激,包括放射線照射、細胞毒性藥物、致癌基因突變(oncogenic activation) 或端粒侵蝕(telomere erosion),進而引發細胞衰老現象,會使細胞永久停止分化(cell cycle arrest),但此等不再分化的衰老細胞在組織中並非只是靜止不動的細胞,它除了可以提供讓細胞不造成癌化的重要機制外,從正常生理機轉的層面而言,對於胚胎發育也有其重要性存在。
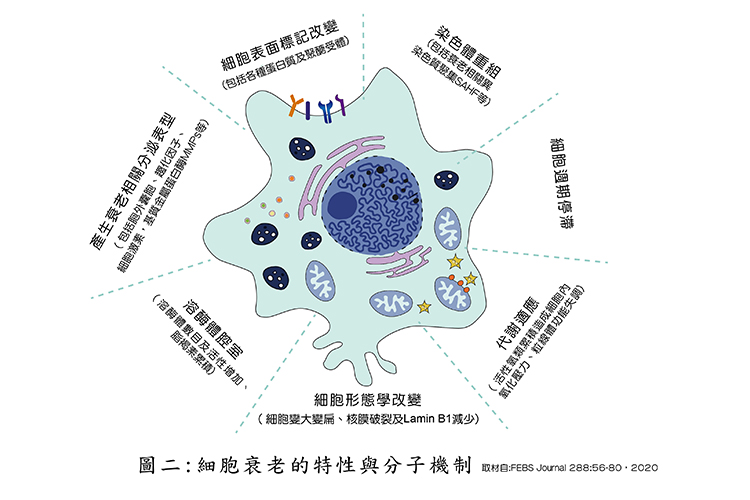
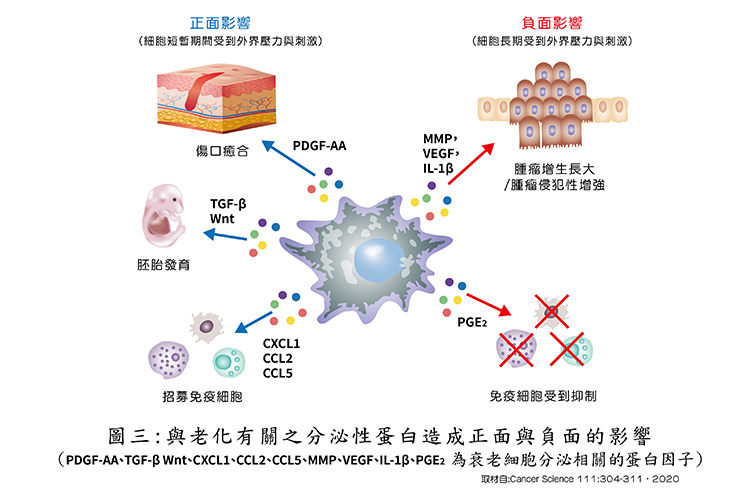
所以,衰老的細胞不全然對身體都造成負面的影響,近年來越來越多的研究顯示,受到刺激進入衰老的細胞,會產生及調節其與衰老相關之分泌蛋白(senescence-associated secretory phenotype,SASP) 這些蛋白多半會誘發很多發炎的細胞因子。
這些誘發產生的發炎因子,有時對傷口癒合及胚胎發育有利,但有時有害,有時會造成癌細胞之產生、擴散、侵襲及器官退化性疾病、老化甚至死亡等(如圖三)。所以,監測或消除老化成因是單一因素還是多元因素,非常重要,仍有繼續研究與探討的空間。
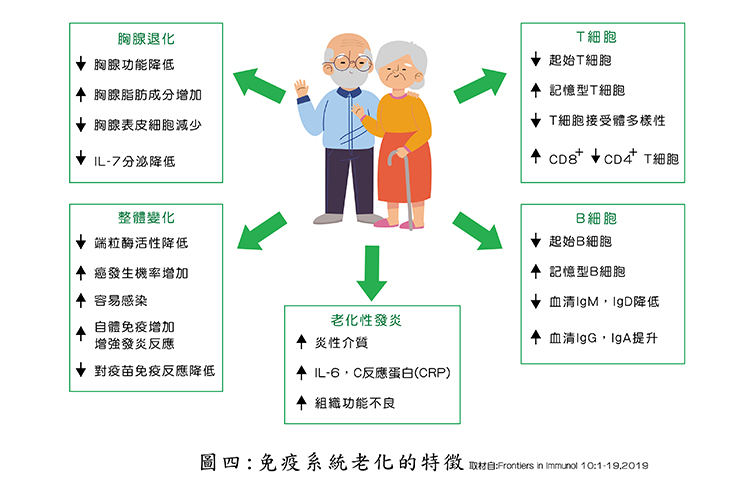
免疫系統老化的特徵
從(圖四)我們可以了解在老化的過程,免疫功能勢必下降,包括起始T細胞之數量下降,記憶型T細胞及B細胞數量上升,淋巴球之功能異常,最後導致老化性發炎(imflamm aging)導致感染、癌症、退化性疾病,甚至自體免疫疾病的產生。另外,Gregg及Guevara二位學者發現,Ercc1基因缺失是導致免疫系統老化的關鍵因子。到2021年美國明尼蘇達醫學院的學者包括Yousefzadeh及Flores等,在《自然醫學期刊》(Nature),發表一篇重要論文,他們認為老化的免疫系統會驅動實質器官的衰老。
另外,他們的研究團隊也證實了衰老細胞是老化過程的關鍵因素,其中免疫細胞的衰老是重中之重,衰老的免疫細胞會加速其他器官衰老,所以最近相繼有許多學者,全心投入探討如何回轉健康的免疫細胞,或使用年輕捐贈者的間質幹細胞注射到衰老的老人,是否可以治療與衰老相關的疾病,如:骨關節炎、心血管疾病、神經退化性疾病等(詳細內容將刊登下個月第二集)。
端粒、端粒酶與老化的關係
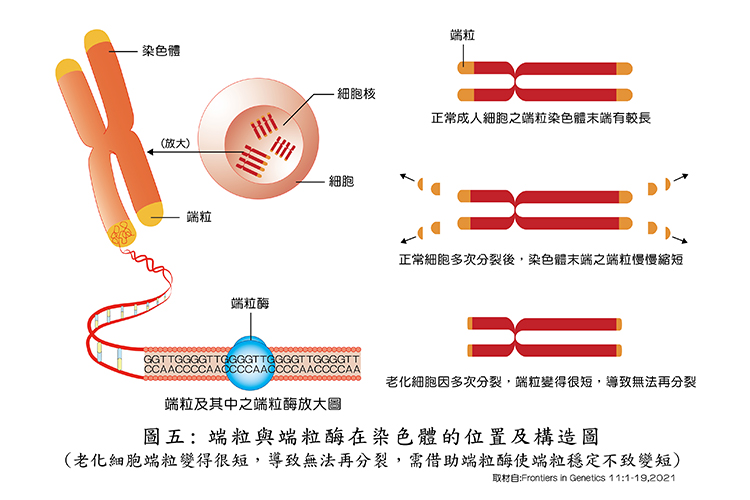
端粒是什麼呢?「端粒」(Telomere)是一種位於細胞染色體末端的結構,可保護染色體基因不受破壞,它像鞋帶之尖端有保護塑膠套一樣,在2009年美國生物學家伊莉莎白•布雷克本(Elizabeth •H,Blackburn)等三人,共同發現端粒是老化關鍵的因素,因而獲得了諾貝爾生理醫學獎。
端粒由相同序列的DNA不斷重複所組成,這些相同的序列在人類上是 「TTAGGG」,並有3000次重複,最長可達15000個鹼基對。端粒的主要功能是避免細胞中重要的遺傳訊息在進行細胞分裂時遺失,因為細胞在進行分裂時,每進行一次細胞分裂,染色體末端就會縮短25~200個鹼基,也因為染色體末端有端粒的保護,因此細胞分裂縮短的鹼基就會發生在端粒上,而不會造成重要遺傳訊息的缺失,隨著細胞分裂的次數越多,端粒的長度就會越來越短,當端粒短到一個臨界長度時,細胞就無法再進行細胞分裂然後走向細胞凋亡(apoptosis)的生理機制,此細胞就會死亡。
一般而言新生兒到成年端粒長度,可長達15000個鹼基對,到35歲則降為7500個,到65歲則降至4800個左右。
生命體中有一種酵素叫做端粒酶(telomerase),端粒酶在細胞中會把重複序列添加到端粒上以維持端粒的長度,在一般的細胞中端粒酶的含量非常低,因此當細胞不斷進行細胞分裂後,就會因為端粒長度過短,導致細胞老化最終走上細胞凋亡,但經過研究發現,在人體中生殖細胞、幹細胞與癌細胞中的端粒酶濃度很高,因此這些細胞可以保持高度的細胞分裂與生理活性;換句話說,這些細胞可以永遠維持在細胞分裂能力與生理的最佳狀態,也就是我們所謂的長生不老(immortal),可見如何保有端粒酶的活性及防止端粒變短,是防止老化重要課題,也是今後臨床與基礎專家學者研究的方向。(如圖五、六)
表觀基因體學與基因體醫學在老化扮演的角色
在本文前述曾經提到老化的特徵中最主要包括:基因體學(Genetics)及表觀基因體學(Epigenetics)的變化,二者同等重要,且需要互補,根據美國哈佛醫學院頗負盛名遺傳學終身教授David A. Sinclair (大衛•辛克萊)在他的暢銷著作《Why We Age, and Why We Don't Have To》(譯名:可不可以不變老,天下出版社有譯著),他對表觀遺傳學與基因學在老化扮演的角色,有非常詳細的探討與闡述,本文做了簡要的歸納,與讀者分享。
辛克萊除了是哈佛大學的遺傳學教授,他目前亦是哈佛大學格林生物老化研究中心的主任,對老化的研究著力很深,他對基因體與表觀基因體學之相互關係有一個非常恰當的比喻,如果把基因體看成電腦,那麼表觀基因體就是「電腦軟體」,表觀基因體負責指示分裂的細胞應該分化成哪種細胞,所以表觀基因體之指令喪失的話,分裂成不同身分細胞的功能會失去,分裂細胞就會失去本身的特性,如此一來組織與器官的功能終將逐漸衰退,所以他認為表觀基因體的遺傳訊號(遺傳指令)的功能失去,將是生物衰老的主要原因。
另外,David A. Sinclair在2020年於《Nature》發表一篇重要的論文,此篇論文特別強調細胞衰老,像年老的小老鼠有嚴重的青光眼,視神經已經受損,但他的研究團隊利用表觀基因體之訊息指令,打開三種基因(Oct4,Sox2,Klf4,簡稱OSK*),送入小鼠的視網膜,視力可以恢復。
由於此篇論文在逆轉老化的相關研究有很大的貢獻,特別刊登於《Nature》該期期刊的封面。他在今年1月19日《Cell》期刊,又再次證實如果表觀基因體之訊息丟失,無法下達指令,是導致生物衰老之重要因素。所以辛克萊滿懷信心地說:「有時候細胞衰老,只是細胞週期停滯,還不到死亡階段,他可以透過表觀基因體重新啟動,可以逆轉,重新變年輕」,這對於逆轉老化,重新啟動表觀基因體時鐘,即所謂DNA的去甲基化,將年齡逆轉是可以實現的。
下集將詳細介紹如何逆轉,敬請期待。[本文中提到OSK*三種基因(Oct4,Sox2,Klf4)連同另一種基因叫c-Myc,共四種基因,即所謂「山中因子」,得名於2012年諾貝爾生理醫學獎得主山中深彌(Shinya Yamanaka),這四個山中因子組合在一起,可以把體細胞轉變成幹細胞。]
延伸閱讀:
。張金堅:癌轉移的先遣部隊:外泌體(Exosomes)
。張金堅:粒線體:人體細胞發電站與癌症的進展息息相關



