本文摘自<常春月刊>477期
文/張金堅(乳癌防治基金會董事長)
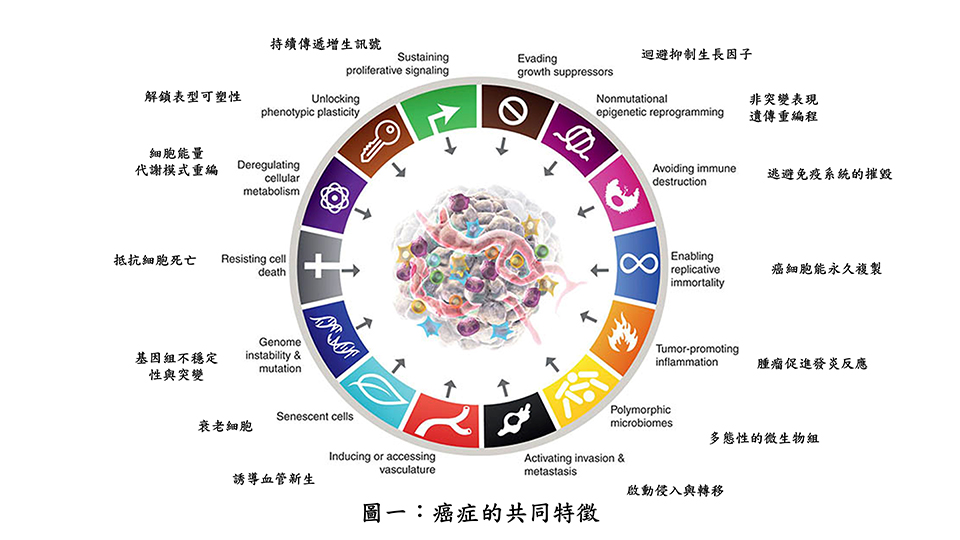
早在2000年美國及瑞士生物學家Bob Weinberg及Douglas Hanahan在知名《細胞期刊》就發表一篇綜述「癌症的特徵」,而後於2011年及今年2022年又分別再做更詳細的闡釋,到目前為止共有十四項特徵(如圖一),其中抵抗細胞死亡(Resisting cell death)、腫瘤促進的發炎反應(Tumor-promoting inflammation)及細胞能量代謝模式重編(Deregulating cellular metabolism),這三項也是其中非常重要的特徵,而粒線體(mitochondria)扮演了這三大特徵中的關鍵角色,粒線體近年來也廣被重視,與癌症的進展息息相關,甚至在癌症治療領域亦有重大突破。
粒線體:細胞的發電站(the powerhouse of the cell)
在演化的過程中,粒線體與葉綠體(chloroplast)是同源的,分屬於動物與植物細胞。早在1857年瑞士解剖及生理學家Rudolf Albert von Kölliker(如圖二)在肌肉細胞中發現顆粒狀結構,及至1898年德國科學家Carl Benda認為這些結構有時呈線狀,有時呈顆粒狀,所以用希臘語中「線(mito)與「顆粒(chondros)」因而有組成mitochondrion之命名,而沿用至今。

粒線體的構造是由兩層膜包被的胞器,直徑在0.5到10微米左右,存在各種細胞內,其大小、數目及外觀上都有不同。粒線體這種胞器,擁有自身的遺傳物質和遺傳體系,但因其基因組大小有限,所以粒線體是一種半自主胞器。粒線體是細胞內氧化磷酸化(
粒線體的雙層包膜,分別為粒線體外膜及粒線體內膜,此外有粒線體膜間隙及粒線體基質。外膜較平滑,內膜則向內皺褶形成粒線體皺褶,負責很多生化反應;皺褶之間叫「粒線體膜間隙」,內膜內包裹的粒線體基質,而基質中含有粒線體自身的DNA(即粒線體DNA,mtDNA)、RNA和核糖體(如圖三)。
.jpg)
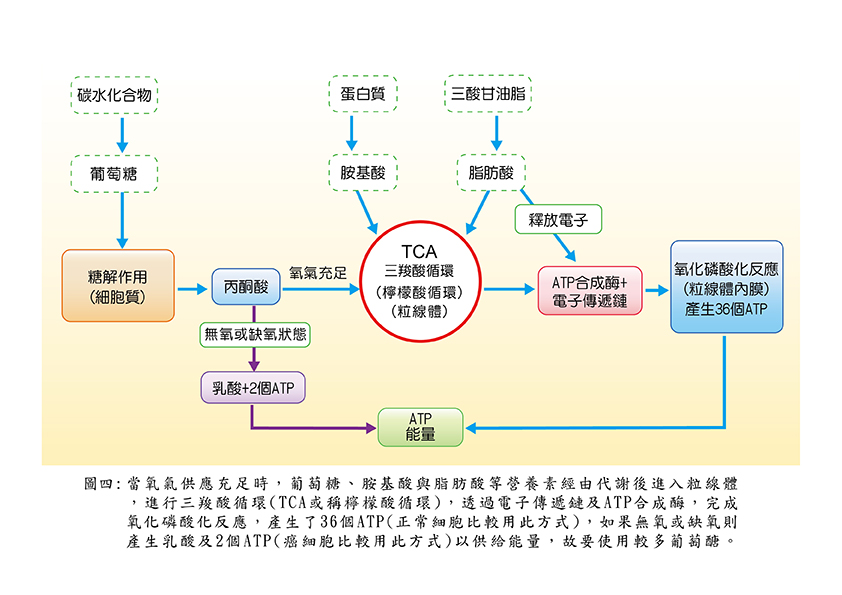
粒線體最廣為人知的便是細胞能量的製造工廠,在細胞質內,葡萄糖被糖解(glycolysis)成為丙酮酸(pyruvate)後進入粒線體,進行三羧酸循環(tricarboxylic acid cycle),又叫「檸檬酸循環」,至於胺基酸及脂肪酸亦可進行此TCA循環,再經一系列之電子傳遞鏈及ATP合成酶之作用,最後產生ATP(共36個ATP),這整個過程叫氧化磷酸化反應(OXPHOS)。如果像癌細胞內氧氣不足或無氧狀態,則丙酮酸無法進入粒線體,只在細胞質產生乳酸及二個ATP,來補足癌細胞所需能量(圖四)。
一個世紀以前,德國科學家Ott Warburg研究癌細胞上的粒線體變化,並提出了有關正常細胞與癌細胞在能量代謝差異的假說,他發現在許多癌細胞有代謝異常的情況:能量仰賴較不經濟的來源,多作用於缺氧(hypoxla)情況下,以乳酸(lactate)為終產物的糖解作用(glycolysis)為主:而正常細胞較常使用的OXPHOS。這種「有氧糖解」(aerobic glycolyss)就是著名的「瓦氏效應」(Warburg effect)。
Warburg據此提出假說,認為「失能的代謝」(dysfunctional metabolism)與「粒線體受損」(mitochondrial damage)是癌症發生的主因,Warburg也因此發現而得到1931年諾貝爾生理及醫學獎。
時至今日,雖然Warburg的理論並非完全正確:癌細胞利用glycolysis並非因粒線體功能「受損」,而是生存演化之必需;且OXPHOS也仍被發現在某些癌細胞亦提供大部分ATP。
粒線體DNA(mitochondrial DNA, mtDNA)突變並不罕見。事實上,幾乎在所有的癌細胞,除了會找到細胞核基因突變外,也都會發現mtDNA的突變。只是除了少數,例如調控TCA cycle酵素的基因:粒線體複合體II上的琥珀酸脱氫酶(succinate dehydrogenase,SDH)突變,與腫瘤的質變(transformation)有直接關係外,大部分mtDNA突變,相較於細胞核基因突變,在癌症發展過程中,只扮演著「乘客」(passenger)的角色。
換句話說,癌細胞還是需要相對「健康」的粒線體來維持增長和侵犯性。粒線體也被證實在腫瘤發生質變、代謝「重設計」(reprogramming),甚至產生抗藥性的過程中扮演關鍵角色。
癌細胞的粒線體的重設計
細胞利用氧化磷酸化反應與糖解作用產生能量,是動態(dynamic)的而非一成不變的。例如成年胸腺細胞有88%的ATP製造來自於氧化磷酸化反應;一旦接受到刺激增生,高達86%的ATP需求轉向產生乳酸的糖化作用。如此轉向將導致在增生(proliferation)細胞中,葡萄糖利用率提升20倍。
這種朝向有氧糖解(aerobic glycolysls)的代謝重設計與乳酸產生對增生細胞帶來一些好處:製造一些能做為抗氧化物的代謝中間產物,製造一個酸性的環境,以改善含氧並刺激血管增生(anglogenesls),及發炎介質的產生,這些都有助於癌細胞在缺氧情況下生存。
近年來,不論是致癌(oncogenic)或抑癌(tumor suppressor)路徑,都被發現直接影響粒線體代謝方式。舉例來說,常見的抑癌基因TP53,負責細胞循環中止(cell-cycle rrest),老化(senescence)及凋亡(apoptosis)。當細胞受到基因毒性(genotoxic)等傷害時,會藉由AMP-活化蛋白酶(AMP-actlvated protein kinase)來活化TP53,透過上調TP53蛋白及促進丙酮酸轉換成acetyl-CoA以進入三羧酸循環(TCA),來提升氧化磷酸化反應及粒線體的「呼吸」功能。
至於癌細胞調控氧化磷酸化反應與糖解作用的方法,目前也被廣泛研究中,其中一個重要物質是伴侶因子(chaperon)熱休克蛋白-90(heat shock protein-90, Hsp90),其主要功能是管控細胞內蛋白質摺疊(protein folding),通過這一物理過程,蛋白質從無規則捲曲摺疊成特定的功能性三維結構,以獲得其功能性結構和構象。熱休克蛋白-90(Hsp90)在癌細胞粒線體內的含量,遠高於正常組織Hsp90除了維持蛋白質摺疊外,並影響細胞膜滲透傳導,電子傳遞鏈,胺基酸合成及細胞氧化還原等重要機制。
實驗發現,粒線體內Hsp90受到完全抑制時,會導致癌細胞經由凋亡方式大量死亡。當接受到細胞凋亡指令時,粒線體是負責執行的細胞器,透過「粒線體外膜滲透」(mitochondrial outer membrane permeabilization, MOMP)的作用,使能殺死細胞的蛋白質從粒線體內膜空間釋放出來。其中最主要的「殺手蛋白質」,便是細胞素c(cytochrome c)而抑制粒線體執行細胞凋亡,是癌細胞產生抗藥性的方式之一。目前備受矚目的癌症幹細胞「cancer stem cell」,以其能頑抗抵制化學治療及放射治療著稱。
與一般癌胞相比,癌症幹細胞有幾種特性:較少量的mtDNA,較高的粒線體膜電位,較低的氧及葡萄糖利用率,以及較低的細胞內活性氧基與ATP濃度。這些都與氧化還原失衡(redox misbalance)以及粒線體的抗氧化功能有關,進而增強癌症幹細胞在惡劣環境下的生存。反之,如果能有藥物破壞癌細胞粒線體功能,便能減緩癌症進展並消滅癌細胞。
粒線體與抗癌治療
目前與粒線體有關的治癌方式,已有很多基礎研究且在臨床上有初步的進展,可分為兩大類:一是「老藥新用」,最有名的就是糖尿病用藥metformin;另一類就是針對粒線體內容物設計的「粒線體毒性」(mitochondriotoxic)藥物,簡單介紹如下:
❶Metformin:肥胖、高血糖、高胰島素血症(hyperinsulinemia)已被公認與癌症進展和預後有關,此路徑也成為癌症治療的標的之一。Metformin是一個治療第Ⅱ型糖尿病的老藥,也被用來治療代謝症候群及卵巢多囊症(polycystlc ovary sydrome);近來許多流行病學及臨床研究都顯示metformin是一個極有潛力的抗癌利器。有關metformin對抗癌細胞的機轉有兩種假說:作用在肝臟減少糖質新生(gluconeogenesls),降低體內含糖量,進而抑制胰島素及類胰島素生長因子-1(Insulin-like growth factor-1,IGF-1),而此二者皆是已知的癌細胞有絲分裂原(mitogen),以此間接降低致癌性(carcinogenesls)。
第二種假說是metformin抑制癌細胞粒線體電子傳遞鏈上的複合體 I (ETC I )活性,直接截斷癌細胞的粒線體能量供應,減少癌細胞增生。Metformin也被發現可以阻斷缺氧誘發因子(hypoxia-Inducible factors,HIFs)路徑,這是幫助癌細胞在缺氧環境下生存的重要系統,在許多癌細胞中都可見到HIFs功能的上調(up-regulation)。因此,如能將metformin與抑制供氧,如血管生成抑制劑(angiogenesis inhibtors)或PI3K抑制劑的藥物併用,將可以更有效的殺死癌細胞。
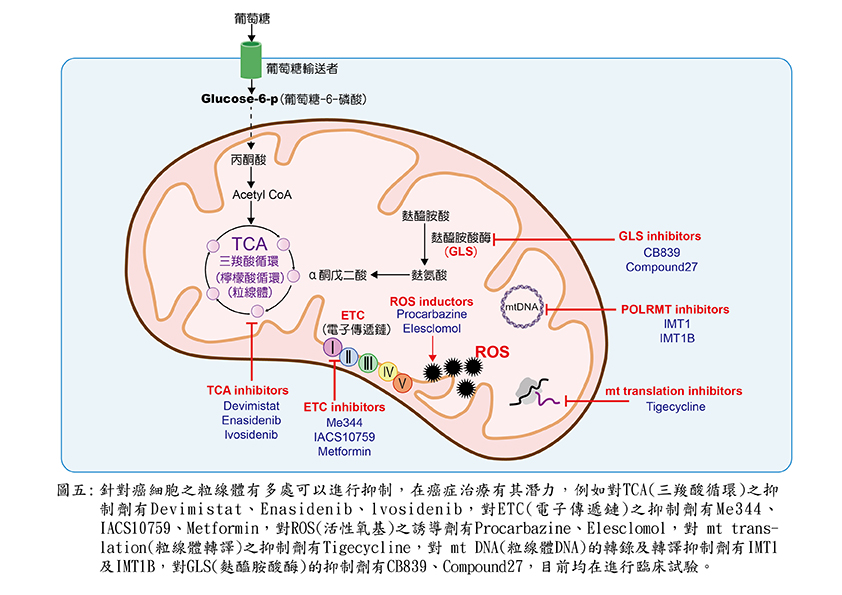
❷粒線體毒性(mitochondriotoxic)藥物:這類藥物有一個新的專有名詞mitocans,mitocan都是以粒線體為標的,誘發細胞凋亡的小分子藥物。作用點從粒線體外膜表面到粒線體基質內,共分為8大類。其中最有名的一類是以粒線體電子傳遞鏈複合體II(complex II)為標的,提升活性氧基(ROS)的藥物,如維生素E類似物(vitamin E analogues):琥珀酸a-生育酚酯(α-tocopheryl succinate, α-TOS)與粒線體靶向維生素E琥珀酸酯(mltochondrially targeted vitamine E succinate, Mito VES)。
這類藥物不只殺死一般腫瘤細胞,更對難纏的癌症幹細胞「cancer stem cell」特別有效。另一種熱休克蛋白-90的抑制物:Gamtrinib,針對粒線體內而非細胞質的Hsp90,導致粒線體快速失能,內膜去極化(depolarization),釋出細胞素C至胞質中,誘發癌細胞凋亡,還有如(圖五)針對癌細胞粒線體多項功能的環節給予抑制,導致癌細胞無法活存,達到治療的效果。
結語
自從Otto Warburg發現癌細胞能量代謝的特性後,粒線體,這個「陳年」細胞器,就不再只是個細胞能量的發電廠了。近年來粒線體已被擺在癌症研究的最前線,包括細胞核與粒線體間的訊號傳遞,以及粒線體如何控制代謝和細胞凋亡路徑,當然還有以粒線體為標的的抗癌治療。雖然研究成果豐碩,仍只是冰山頂上的一角而已。
例如前述的粒線體毒性物,多仍在第一或二期臨床試驗階段,包括metformin在抗癌治療中的角色,及與何種化療物搭配最合適,仍未有定論。待大型臨床試驗證實其療效及安全性,並廣泛使用在癌症病人身上,仍有很長的路要走。
無論如何,粒線體的活性與代謝路徑,已被證實在腫瘤生長及增殖所需的能量供應中,扮演樞紐的角色。因此,粒線體勢必成為將來癌症治療甚至化學預防(chemoprevention)的新標的,也是一條癌症治療具有前景的新路,值得大家繼續期待與努力。
延伸閱讀:
。張金堅:不要輕忽晝夜節律,與癌症的發生亦有關係
。張金堅:談缺氧與癌症進展的關係



